你的位置:杠杆的利息_融券的杠杆_高杠杆投资 > 融券的杠杆 >
可信的炒股配资 维迪西妥单抗乳腺癌适应症获批 | 徐兵河教授: C006 Ⅲ期研究取得阳性结果,HER2阳性乳腺癌伴肝转移迎来高效低毒新方案
发布日期:2025-05-27 21:36 点击次数:109

2025年5月9日,国家药品监督管理局药品审评中心(NMPA CDE)官网传来喜讯,维迪西妥单抗正式获批用于既往接受过曲妥珠单抗(或其生物类似药)和紫杉类药物治疗的HER2阳性且存在肝转移的晚期乳腺癌患者。这是乳腺癌治疗领域的又一突破性进展,HER2阳性乳腺癌伴肝转移患者迎来治疗新希望。
该适应症是基于RC48-C006研究的Ⅲ期数据:维迪西妥单抗对比拉帕替尼+卡培他滨治疗HER2阳性乳腺癌伴肝转移患者可显著延长生存获益,中位PFS翻倍获益(9.9个月 vs 4.9个月),且安全性良好。值此重要时刻,本报特邀RC48-C006研究的Leading PI徐兵河教授,解读HER2阳性乳腺癌伴肝转移的诊疗现状及C006研究成果,并探讨维迪西妥单抗在HER2阳性乳腺癌伴肝转移患者中的临床应用前景。
未被满足之需,生存亟待破局
论坛报:请您分享一下HER2阳性伴肝转移晚期乳腺癌的诊疗现状。
徐兵河教授
乳腺癌是全球女性最常见的恶性肿瘤之一,其致死原因大部分是肿瘤转移,其中肝转移是乳腺癌患者中较为严重且具有高度致死性的转移类型。约17.8%~35%的转移性乳腺癌患者会发生肝转移,其中HER2阳性亚型的肝转移发生率明显高于其他分子分型,约达45%[1-4]。针对SEER数据库中311573例乳腺癌患者的分析显示,对比HR+/HER2-亚型,HR+/HER2+、HR-/HER2+、三阴性亚型乳腺癌发生肝转移的风险显著增高,比值比(OR)分别为3.13、4.75和1.92[1]。此外,不同原发癌种的肝转移占比分析表明,乳腺癌是仅次于肺癌的第二大高发癌种 [5]。这些数据提示,HER2阳性乳腺癌的生物学行为更易侵袭肝脏,肝转移已成为该亚型晚期患者的重要临床特征。
肝转移是影响乳腺癌患者长期生存和生活质量的重要因素,伴有肝转移的乳腺癌患者的5年生存率仅为8.5%[6,7]。广泛的肝转移不仅导致肝功能受损(如黄疸、凝血障碍),还可能引发全身症状(如乏力、厌食),进一步降低患者对治疗的耐受性。
目前,肝转移患者的治疗选择仍面临显著局限:局部治疗(如手术、放疗)虽可在经过严格筛选的寡转移患者中实现一定临床获益,但其适用人群狭窄,且对长期生存的改善作用有限;全身系统性治疗仍是延长生存的核心手段,但部分方案(如化疗)的肝毒性风险常导致应用受限。针对HER2阳性伴肝转移的晚期乳腺癌患者,当前主要系统治疗方案以抗HER2靶向药物联合化疗为主。多项研究证实,抗HER2靶向药物治疗HER2阳性伴肝转移乳腺癌有显著获益[1]。然而,一旦疾病进展,后续治疗选择极为有限,存在巨大未被满足的临床需求。因此,如何突破现有治疗瓶颈、丰富治疗选择、延长生存获益,是临床亟待解决的难题。
引领破局肝转,中位PFS翻倍获益
论坛报:您担任Leading PI的RC48-C006研究探索了维迪西妥单抗治疗HER2阳性伴肝转移晚期乳腺癌的有效性和安全性,能否请您简要介绍该研究的设计及主要发现?
徐兵河教授
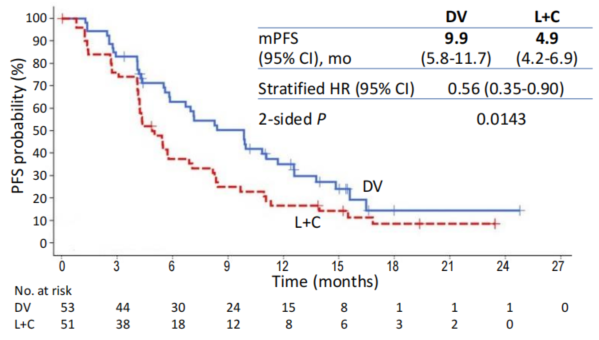
RC48-C006研究是一项对比HER2靶向ADC药物维迪西妥单抗(DV)与传统方案拉帕替尼联合卡培他滨(L+C)治疗晚期/转移性乳腺癌的随机、多中心、开放标签Ⅱ期/Ⅲ期研究[8]。在Ⅱ期阶段,我们观察到在肝转移亚组人群中,DV组中位无进展生存期(PFS)显著延长至12.5个月(L+C组仅为5.6个月,HR=0.44),这一结果获得NMPA突破性疗法认定并促使研究提前进入Ⅲ期确证阶段。Ⅲ期阶段聚焦于肝转移人群,共纳入104例既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性晚期乳腺癌伴肝转移患者(DV组53例,L+C组51例),主要终点为独立评审委员会(IRC)评估的PFS。在2024年圣安东尼奥乳腺癌研讨会(SABCS)上,首次报告了Ⅲ期研究结果。
截至2023年12月31日的数据显示,维迪西妥单抗的疗效获益显著优于拉帕替尼联合卡培他滨。在IRC评估中,DV组的中位PFS达到9.9个月,较L+C组的4.9个月延长超过一倍(HR=0.56,95%CI: 0.35-0.90;双侧P=0.0143),这一结果在后线治疗背景下尤为突出。研究者评估的PFS结果(HR=0.62)与IRC数据高度一致,进一步验证了疗效的可靠性。此外,DV组的客观缓解率(ORR)为58.5%,疾病控制率(DCR)高达94.3%,缓解持续时间(DoR)达到11.2个月,表明其抗肿瘤活性更持久且稳定。
IRC评估的PFS结果
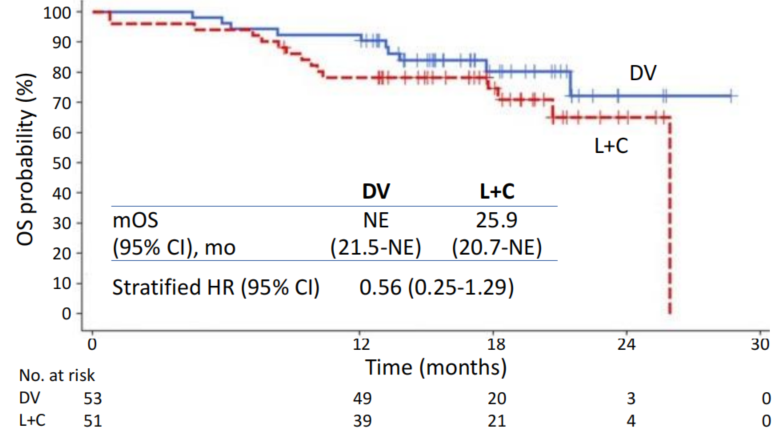
尽管总生存期(OS)数据尚未成熟,但早期趋势已显示出DV的潜在生存优势。DV组的中位OS尚未达到(NE),而对照组为25.9个月(HR=0.56,95%CI: 0.25-1.29)。值得注意的是,对照组中41.2%的患者在疾病进展后交叉至DV组,经调整交叉治疗影响后,风险比(HR)进一步优化至0.18~0.55,提示DV可能为患者带来更显著的长期生存获益。这一发现为后续OS数据的最终分析提供了乐观预期。
OS结果
并且,RC48-C006研究纳入的人群也覆盖了肝转移合并其他脏器转移的晚期乳腺癌患者。初步分析能看出在肝转移合并肺转移的亚组中有更好疗效的趋势,完整的亚组数据分析结果将在后续正式发表,也期待未来能有更大样本量的临床研究探索乳腺癌伴多器官转移的治疗方案,为这部分难治性人群提供新的生存希望。
RC48-C006研究令人惊喜的临床价值,不仅体现在为患者带来的显著疗效获益上,更在于其开创性地填补了乳腺癌肝转移治疗领域的循证空白。近年来,尽管乳腺癌治疗策略日趋精准,且越来越多的临床研究聚焦肿瘤异质性探索个体化治疗方案,但当前晚期乳腺癌治疗指南涉及的研究中大部分未报告针对肝转移亚组的疗效数据,此前已获批的ADC类药物也未明确乳腺癌肝转移患者的获益差异[9,10]。针对HER2阳性肝转移晚期乳腺癌的前瞻性随机对照试验(RCT)更为稀缺。RC48-C006研究是全球首个该领域确证性Ⅲ期RCT,首次以高级别循证医学证据证实:新一代HER2靶向ADC药物可显著改善HER2阳性伴肝转移晚期乳腺癌患者的生存结局。维迪西妥单抗针对乳腺癌肝转移这一难治性领域走在了临床前端,展现了中国自主研发创新药的坚实实力。
中国原研突破,肝转患者优选
论坛报:基于RC48-C006研究,维迪西妥单抗正式获NMPA批准用于既往接受过曲妥珠单抗(或其生物类似药)和紫杉类药物治疗的HER2阳性且存在肝转移的晚期乳腺癌患者,请您谈谈该适应证获批对乳腺癌的临床实践有怎样的积极影响?
此次维迪西妥单抗适应症获批,是HER2阳性伴肝转移乳腺癌治疗领域的一项重大进展。对于临床实践而言,这一突破意味着医生和患者从此多了一个高效且安全的治疗优选。长期以来,肝转移患者因预后较差、后线治疗选择匮乏,临床医生在制定个体化治疗方案时常缺乏循证指引。RC48-C006研究为临床决策提供了坚实的循证依据,维迪西妥单抗的获批为临床实践增添了新的抗癌利器,为广大患者带来新的希望。
同时,这也是我国自主创新药物研发实力的重要体现。维迪西妥单抗是首个国产新一代HER2靶向ADC药物,此前已在胃癌和尿路上皮癌领域获批并纳入国家医保目录,积累了丰富的临床应用经验。在乳腺癌领域,治疗HER2阳性伴肝转移乳腺癌获NMPA突破性疗法认定,2024年SABCS上公布的Ⅲ期阳性结果,更获得国际同行的高度认可。此次NMPA的快速审批,不仅体现了国家药监局对创新药物的支持,也为中国原研创新药后续适应症拓展奠定了基础。未来,我们期待维迪西妥单抗能早日纳入医保,进一步降低患者经济负担,惠及更多家庭。
展望未来,我们期待更多研究探索维迪西妥单抗与免疫治疗、局部治疗的联合潜力,同时也呼吁行业关注肝转移的分子机制和耐药性突破。唯有持续推动创新药物研发与临床转化,才能为患者赢得更长的生存时间和更高的生活质量。这一目标的实现,需要学界、产业界和监管机构的共同努力,而维迪西妥单抗的获批,无疑迈出了关键一步。
更具安全性ADC,联合保障协同增效
论坛报:对于晚期肿瘤患者而言,治疗安全性和疗效结果一样也是临床关注的焦点,请您分享一下应用维迪西妥单抗治疗乳腺癌的安全性体验以及不良反应管理策略。
不同ADC药物的不良反应具有独特性,常见需要警惕的主要有血小板减少、肝毒性、心脏毒性、中性粒细胞减少、间质性肺疾病(ILD)、LVEF降低、腹泻等。从RC48-C006研究的Ⅲ期数据来看,维迪西妥单抗的整体安全性可控,未发生5级死亡事件,3~4级治疗相关不良事件(TRAEs)发生率为37.7%,是目前市场上ADC药物里最低的,并且未发生ADC药物最常见的严重不良反应如间质性肺炎/肺病、及血小板减少症等。安全谱与既往研究一致,未出现新的非预期毒性信号,为临床用药的安全性提供了重要保障。
根据RC48-C006研究,维迪西妥单抗最常见的3级以上TRAEs为血液毒性,包括中性粒细胞减少(18.9%)和白细胞减少(5.7%),而外周神经病变发生率<5%。对于血液毒性,可以在治疗前基线评估血常规,治疗期间定期监测(如每周期前),若出现3~4级减少,可考虑剂量调整或联合支持性治疗。对于外周神经病变,临床上可以用低温疗法或压迫疗法来预防,同时也可以给予地塞米松进行预处理,RC48-C001&C003研究中发现给予地塞米松预处理将显著降低外患者周神经病变的发生率,且能延迟首次周围神经病变的发生时间近5个月[11]。
总体而言,维迪西妥单抗安全耐受,不良反应均可预期可管理,并能有效维持治疗的连续性。基于良好的安全性可信的炒股配资,目前已有临床研究显示出维迪西妥单抗联合方案的疗效优势,未来也期待能积极探索更多联合方案的可能性,在保障安全性的基础上增加联合协同效应,让更多乳腺癌患者从这一国创原研ADC药物中获益。